GAYA VAN DER WAALS
Come back friends…, kali ini saya akan membagi materi tentang gaya van der waals yang mana ini termasuk salah satu konsep-konsep yang diperlukan dalam mempelajari struktur molekul organik. Nah langsung aja dimulai dari sejarahnya..
Johannes Diderik van der Waals (23 November 1837 – 8 Maret 1923) ialah ilmuwan Belanda yang terkenal “atas karyanya pada persamaan gas cairan”, sehingga ia memenangkan Penghargaan Nobel dalam Fisika pada 1910. van der Waals adalah yang pertama menyadari perlunya mengingat akan volume molekul dan gaya antarmolekul (kini disebut “gaya van der Waals”) dalam mendirikan hubungan antara tekanan, volume, dan suhu gas dan cairan.
Gaya van der Waals dalam ilmu kimia merujuk pada jenis tertentu gaya antar molekul. Istilah ini pada awalnya merujuk pada semua jenis gaya antar molekul, dan hingga saat ini masih kadang digunakan dalam pengertian tersebut, tetapi saat ini lebih umum merujuk pada gaya-gaya yang timbul dari polarisasi molekul menjadi dipole. Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau bebas (gaya Debye) serta pergeseran distribusi awan elektron (gaya London).
Nama gaya ini diambil dari nama kimiawan Belanda Johannes van der Waals, yang pertama kali mencatat jenis gaya ini. Potensial Lennard-Jones sering digunakan sebagai model hampiran untuk gaya van der Waals sebagai fungsi dari waktu.Interaksi van der Waals teramati pada gas mulia, yang amat stabil dan cenderung tak berinteraksi. Hal ini menjelaskan sulitnya gas mulia untuk mengembun. Tetapi, makin besar ukuran atom gas mulia (makin banyak elektronnya) makin mudah gas tersebut berubah menjadi cairan.
Gas mempunyal sifat bentuk dan volumenya dapat berubah sesuai tempatnya. Jarak antara molekul-molekul gas relatif jauh dan gaya tarik menariknya sangat lemah. Pada penurunan suhu, fasa gas dapat berubah menjadi fasa cair atau padat. Pada keadaan ini jarak antara molekul-molekulnya menjadi lebih dekat dan gaya tarik menariknya relatif lebih kuat. Gaya tarik menarik antara molekul-molekul yang berdekatan inidisebut gaya Van der walls.
Gaya van der waals : gaya tarik di antara atom atau molekul, gaya ini jauh lebih lemah dibandingkan gaya yang timbul karena ikatan valensi dan besarnya ialah 10-7 kali jarak antara atom-atom atau molekul-molekul. Gaya ini menyebabkan sifat tak ideal pada gas dan menimbulkan energi kisi pada kristal molekular.
Ada tiga hal yang menyebabkan gaya ini :
Interaksi dikutub - kutub, yaitu tarikan elektrostatistik di antara dua molekul dengan moment dikutub permanen.
Interaksi dikutub imbasan, artinya dikutub timbul karena adanya polarisasi oleh molekul tetangga.
Gaya dispersi yang timbul karena dikutub kecil dan bersifat sekejap dalam atom.
BUKTI GAYA VAN DER WAALS
Banyak bukti menunjukkan bahwa ada gaya tarik antara molekul,contohnya Cl2.
Cl Cl . . . . . . . . Cl Cl
Gaya van der waals
Gaya ini disebut gaya van der waals dan sangat lemah dibandingkan ikatan ion dan kovalen.Dalam molekul Cl2 terdapat ikatn kovalen dengan energi ikatan 240 kj/mol,dan antara molekul Cl2 terdapat gaya van der waals sebesar 21 kj/mol.
Gaya van der waals dapat terjadi antara partikel yang sama atau berbeda .sama halnya dengan gaya kohesi (gaya antara partikel – partikel zat yang sama ) yang di pelajari disekolah lanjutan.gaya ini terjadi karena adanya sifat kepolaran partikel tersebut.makin kecil kepolaran makin kecil pila gaya van der waals-nya.
Antaraksi ion – dipol
Partikel yang berbeda dapat saling berikatan atau tarik menarik bila yang pertama adalah ion dan yang lain molekul polar ( dipol ).gaya tarik listrik ini disebut antaraksi ion – dipol,contohnya :
H+ + H2O H3O+
Ag+ + 2NH3 Ag(NH3 )2+
Al+ + 6 H2O Al(H2O)63+
Na+ + n H2O Na(OH2)n+
F- + m H2O F (H2O)m-
Gaya ini cukup kuat dan sangat penting dalam proses pelarutan zat dalam pelarut,ion positif atau negatif dapat pelarut polar,contohnya :
· NaCl ( senyawa ion ) dapat larut dalam air ( pelarut polar )
· AgBr ( senyawa ion )larut dalam NH3 ( pelarut polar )
Gaya Dipol-dipol
Gaya dipol-dipol adalah gaya tarik menarik yang terjadi antara molekul polar. Sebuah molekul hydrogen klorida memilki atom hydrogen sebagian positif dan atom klor sebagian negative. Dalam kumpulan banyak molekul hydrogen klorida, mereka akan mensejajarkan diri agar daerah bermuatan sebaliknya dari molekul tetangga berdekatan satu sama lain.
Gaya Dispersi London
Gaya dispersi juga dianggap sebagai jenis van der Waals dan yang paling lemah dari semua gaya antarmolekul. Mereka sering disebut Gaya London setelah Fritz London (1900-1954), yang pertama kali mengajukan keberadaan mereka pada tahun 1930. Gaya dispersi London adalah gaya antarmolekul yang terjadi antara atom dan antara molekul nonpolar akibat gerakan elektron.
gaya dipole
dipol sesaat helium
Sebuah dipol singkat atau seketika dalam sebuah atom helium.
Dipol sesaat dan akan menginduksi secara lemah tertarik satu sama lain. Gaya dispersi meningkat seiring jumlah elektron dalam atom atau molekul nonpolar yang meningkat.
Kelompok halogen terdiri dari empat unsur yang semua mengambil bentuk molekul diatomik nonpolar. Tabel di bawah ini menunjukkan perbandingan titik leleh dan didih untuk masing-masing.
Titik leleh dan titik cair Halogen
Molecule
Jumlah elektron
Titik leleh (°C)
Titik didih ( °C)
Keadaan fisik pada suhu kamar
F2
18
-220
-188
gas
Cl2
34
-102
-34
gas
Br2
70
-7
59
cair
I2
106
114
184
padat
Gaya dispersi yang kuat untuk molekul yodium karena mereka memiliki jumlah terbesar dari elektron. Gaya yang relatif kuat menghasilkan titik leleh dan titik didih yang tertinggi dari kelompok halogen.
Gaya ini cukup kuat untuk menahan molekul yodium berdekatan dalam keadaan padat pada suhu kamar. Gaya dispersi yang semakin lemah untuk brom, klorin, dan fluorin dan ini diilustrasikan dalam titik leleh dan titik didih yang lebih rendah pada mereka. Brom ada dalam bentuk cair pada suhu kamar, sedangkan klorin dan fluor adalah gas, dengan molekul yang lebih jauh terpisah dari satu sama lain. Gaya antarmolekul hampir tidak ada dalam keadaan gas, sehingga gaya dispersi dalam klorin dan fluor hanya menjadi terukur saat suhu menurun dan mereka mengembun menjadi keadaan cair.
Ringkasan
Gaya van der Waals adalah interaksi lemah antara molekul yang melibatkan dipol.Molekul polar memiliki interaksi dipol-dipol permanen.
Molekul non-polar dapat berinteraksi dengan cara gaya dispersi London
KESIMPULAN
1. Dayatarik antarmolekul adalah dayatarik yang terjadi antara suatu molekul dan molekul tetangganya. Gaya tarik yang mengikat molekul secara tersendiri (sebagai contoh, ikatan kovalen) dikenal dengan dayatarik intramolekul
2. Gaya tarik menarik antara molekul-molekul yang berdekatan inidisebut gaya Van der walls.
Ada tiga hal yang menyebabkan gaya ini :
Interaksi dikutub - kutub, yaitu tarikan elektrostatistik di antara dua molekul dengan moment dikutub permanen.
Interaksi dikutub imbasan, artinya dikutub timbul karena adanya polarisasi oleh molekul tetangga.
Gaya dispersi yang timbul karena dikutub kecil dan bersifat sekejap dalam atom.
DAFTAR PUSTAKA
1. Michelle Lee. (1999). van der Waals Forces: [Online]. Tersedia: http://educhem.com. [13 Januari 2008].
2. Syukri S,1999,KIMIA DASAR JILID 1,Bandung :ITB,hal.240- 243
3. D.Sarker Satyajid, Lutfun Nahar.2009,BAHAN KIMIA ORGANIK,ALAM DAN UMUM.Yogyakarta : Pustaka pelajar,hal. 38-39
Come back friends…, kali ini saya akan membagi materi tentang gaya van der waals yang mana ini termasuk salah satu konsep-konsep yang diperlukan dalam mempelajari struktur molekul organik. Nah langsung aja dimulai dari sejarahnya..
Johannes Diderik van der Waals (23 November 1837 – 8 Maret 1923) ialah ilmuwan Belanda yang terkenal “atas karyanya pada persamaan gas cairan”, sehingga ia memenangkan Penghargaan Nobel dalam Fisika pada 1910. van der Waals adalah yang pertama menyadari perlunya mengingat akan volume molekul dan gaya antarmolekul (kini disebut “gaya van der Waals”) dalam mendirikan hubungan antara tekanan, volume, dan suhu gas dan cairan.
Gaya van der Waals dalam ilmu kimia merujuk pada jenis tertentu gaya antar molekul. Istilah ini pada awalnya merujuk pada semua jenis gaya antar molekul, dan hingga saat ini masih kadang digunakan dalam pengertian tersebut, tetapi saat ini lebih umum merujuk pada gaya-gaya yang timbul dari polarisasi molekul menjadi dipole. Hal ini mencakup gaya yang timbul dari dipol tetap (gaya Keesom), dipol rotasi atau bebas (gaya Debye) serta pergeseran distribusi awan elektron (gaya London).
Nama gaya ini diambil dari nama kimiawan Belanda Johannes van der Waals, yang pertama kali mencatat jenis gaya ini. Potensial Lennard-Jones sering digunakan sebagai model hampiran untuk gaya van der Waals sebagai fungsi dari waktu.Interaksi van der Waals teramati pada gas mulia, yang amat stabil dan cenderung tak berinteraksi. Hal ini menjelaskan sulitnya gas mulia untuk mengembun. Tetapi, makin besar ukuran atom gas mulia (makin banyak elektronnya) makin mudah gas tersebut berubah menjadi cairan.
Gas mempunyal sifat bentuk dan volumenya dapat berubah sesuai tempatnya. Jarak antara molekul-molekul gas relatif jauh dan gaya tarik menariknya sangat lemah. Pada penurunan suhu, fasa gas dapat berubah menjadi fasa cair atau padat. Pada keadaan ini jarak antara molekul-molekulnya menjadi lebih dekat dan gaya tarik menariknya relatif lebih kuat. Gaya tarik menarik antara molekul-molekul yang berdekatan inidisebut gaya Van der walls.
Gaya van der waals : gaya tarik di antara atom atau molekul, gaya ini jauh lebih lemah dibandingkan gaya yang timbul karena ikatan valensi dan besarnya ialah 10-7 kali jarak antara atom-atom atau molekul-molekul. Gaya ini menyebabkan sifat tak ideal pada gas dan menimbulkan energi kisi pada kristal molekular.
Ada tiga hal yang menyebabkan gaya ini :
Interaksi dikutub - kutub, yaitu tarikan elektrostatistik di antara dua molekul dengan moment dikutub permanen.
Interaksi dikutub imbasan, artinya dikutub timbul karena adanya polarisasi oleh molekul tetangga.
Gaya dispersi yang timbul karena dikutub kecil dan bersifat sekejap dalam atom.
BUKTI GAYA VAN DER WAALS
Banyak bukti menunjukkan bahwa ada gaya tarik antara molekul,contohnya Cl2.
Cl Cl . . . . . . . . Cl Cl
Gaya van der waals
Gaya ini disebut gaya van der waals dan sangat lemah dibandingkan ikatan ion dan kovalen.Dalam molekul Cl2 terdapat ikatn kovalen dengan energi ikatan 240 kj/mol,dan antara molekul Cl2 terdapat gaya van der waals sebesar 21 kj/mol.
Gaya van der waals dapat terjadi antara partikel yang sama atau berbeda .sama halnya dengan gaya kohesi (gaya antara partikel – partikel zat yang sama ) yang di pelajari disekolah lanjutan.gaya ini terjadi karena adanya sifat kepolaran partikel tersebut.makin kecil kepolaran makin kecil pila gaya van der waals-nya.
Antaraksi ion – dipol
Partikel yang berbeda dapat saling berikatan atau tarik menarik bila yang pertama adalah ion dan yang lain molekul polar ( dipol ).gaya tarik listrik ini disebut antaraksi ion – dipol,contohnya :
H+ + H2O H3O+
Ag+ + 2NH3 Ag(NH3 )2+
Al+ + 6 H2O Al(H2O)63+
Na+ + n H2O Na(OH2)n+
F- + m H2O F (H2O)m-
Gaya ini cukup kuat dan sangat penting dalam proses pelarutan zat dalam pelarut,ion positif atau negatif dapat pelarut polar,contohnya :
· NaCl ( senyawa ion ) dapat larut dalam air ( pelarut polar )
· AgBr ( senyawa ion )larut dalam NH3 ( pelarut polar )
Gaya Dipol-dipol
Gaya dipol-dipol adalah gaya tarik menarik yang terjadi antara molekul polar. Sebuah molekul hydrogen klorida memilki atom hydrogen sebagian positif dan atom klor sebagian negative. Dalam kumpulan banyak molekul hydrogen klorida, mereka akan mensejajarkan diri agar daerah bermuatan sebaliknya dari molekul tetangga berdekatan satu sama lain.
Gaya Dispersi London
Gaya dispersi juga dianggap sebagai jenis van der Waals dan yang paling lemah dari semua gaya antarmolekul. Mereka sering disebut Gaya London setelah Fritz London (1900-1954), yang pertama kali mengajukan keberadaan mereka pada tahun 1930. Gaya dispersi London adalah gaya antarmolekul yang terjadi antara atom dan antara molekul nonpolar akibat gerakan elektron.
gaya dipole
Gaya dipol-dipol adalah hasil dari daya tarik ujung positif dipol yang satu ke ujung negatif dari dipol tetangga.
Awan elektron dari atom helium berisi dua elektron, yang biasanya diperkirakan akan merata secara spasial di sekitar inti. Namun, pada saat tertentu distribusi elektron mungkin tidak merata, sehingga timbul dipol sesaat. Dipol lemah dan sementara ini kemudian mempengaruhi atom tetangga helium melalui tarik dan tolakan elektrostatik. Ini akan menginduksi dipol atom helium terdekat (lihat Gambar di bawah).dipol sesaat helium
Sebuah dipol singkat atau seketika dalam sebuah atom helium.
Dipol sesaat dan akan menginduksi secara lemah tertarik satu sama lain. Gaya dispersi meningkat seiring jumlah elektron dalam atom atau molekul nonpolar yang meningkat.
Kelompok halogen terdiri dari empat unsur yang semua mengambil bentuk molekul diatomik nonpolar. Tabel di bawah ini menunjukkan perbandingan titik leleh dan didih untuk masing-masing.
Titik leleh dan titik cair Halogen
Molecule
Jumlah elektron
Titik leleh (°C)
Titik didih ( °C)
Keadaan fisik pada suhu kamar
F2
18
-220
-188
gas
Cl2
34
-102
-34
gas
Br2
70
-7
59
cair
I2
106
114
184
padat
Gaya dispersi yang kuat untuk molekul yodium karena mereka memiliki jumlah terbesar dari elektron. Gaya yang relatif kuat menghasilkan titik leleh dan titik didih yang tertinggi dari kelompok halogen.
Gaya ini cukup kuat untuk menahan molekul yodium berdekatan dalam keadaan padat pada suhu kamar. Gaya dispersi yang semakin lemah untuk brom, klorin, dan fluorin dan ini diilustrasikan dalam titik leleh dan titik didih yang lebih rendah pada mereka. Brom ada dalam bentuk cair pada suhu kamar, sedangkan klorin dan fluor adalah gas, dengan molekul yang lebih jauh terpisah dari satu sama lain. Gaya antarmolekul hampir tidak ada dalam keadaan gas, sehingga gaya dispersi dalam klorin dan fluor hanya menjadi terukur saat suhu menurun dan mereka mengembun menjadi keadaan cair.
Ringkasan
Gaya van der Waals adalah interaksi lemah antara molekul yang melibatkan dipol.Molekul polar memiliki interaksi dipol-dipol permanen.
Molekul non-polar dapat berinteraksi dengan cara gaya dispersi London
KESIMPULAN
1. Dayatarik antarmolekul adalah dayatarik yang terjadi antara suatu molekul dan molekul tetangganya. Gaya tarik yang mengikat molekul secara tersendiri (sebagai contoh, ikatan kovalen) dikenal dengan dayatarik intramolekul
2. Gaya tarik menarik antara molekul-molekul yang berdekatan inidisebut gaya Van der walls.
Ada tiga hal yang menyebabkan gaya ini :
Interaksi dikutub - kutub, yaitu tarikan elektrostatistik di antara dua molekul dengan moment dikutub permanen.
Interaksi dikutub imbasan, artinya dikutub timbul karena adanya polarisasi oleh molekul tetangga.
Gaya dispersi yang timbul karena dikutub kecil dan bersifat sekejap dalam atom.
DAFTAR PUSTAKA
1. Michelle Lee. (1999). van der Waals Forces: [Online]. Tersedia: http://educhem.com. [13 Januari 2008].
2. Syukri S,1999,KIMIA DASAR JILID 1,Bandung :ITB,hal.240- 243
3. D.Sarker Satyajid, Lutfun Nahar.2009,BAHAN KIMIA ORGANIK,ALAM DAN UMUM.Yogyakarta : Pustaka pelajar,hal. 38-39
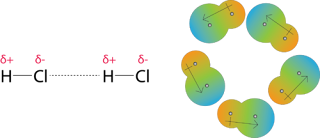



Terima kasih atas penjelasannya sangat bermanfaat
BalasHapusKembali Kasih
HapusTerima kasih ulasan yang sangat bermanfaat.
BalasHapusYa kembali Kasih saudari lili
Hapusterimakasih atas materinya
BalasHapusterimakasih atas materinya, sangat bermanfaat. Saya ingin bertanya bagaimana aplikasi gaya van der waals dalam kehidupan sehari-hari?
BalasHapusIya baiklah contohnya sangat sederhana yaitu larutan garam (NaCl+H20) serta larutan gula yang mengalami gaya van der waals
HapusMaterinya sangat bagus terimakasih min
BalasHapusIya kembali Kasih :)
Hapusterima kasih materinya, sangat bermanfaat
BalasHapusIya terimakasih kembali sudah mampir
HapusIya terimakasih kembali sudah mampir
HapusTerimakasih materinya, bermanfaat
BalasHapusTerima kasih ilmu nya..
BalasHapussaya masukan untk ditmbh lagi contoh2 pendukung agar kmi pembaca lebih memahami
Materi yang bermanfaat, terimakasih :)
BalasHapus