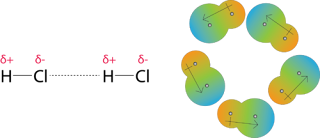polarizabilitas

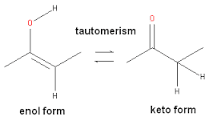
POLARIZABILITAS Salam kimia !!!! kembali bertemu dengan postingan terbaru saya mengenai salah satu faktor yang di perlukan dalam mempelajari senyawa organik dan salah satunya yang akan saya bahas dalam postingan kali ini yaitu “Polarizabilita atau polarisabilitas” . Nah sebelum saya bahas lebih lanjut tentang apa itu polarisabilitas FYI polarisa bilitas sendiri merupakan kemampuan suatu molekul untuk mengimbas molekul lain untuk membentuk dipole sesaat. Elektron pada suatu atom mengalami pergerakan dalam orbital. Pergerakan atau perpindahan elektron pada suatu atom dapat mengakibatkan tidak meratanya kepadatan elektron pada atom, sehingga atom tersebut mempunyai satu sisi dipol dengan muatan lebih negatif dibandingkan sisi yang lain. Pergerakan ini menimbulkan dipol sesaat. Gambar 1. menggambarkan perbedaan sebaran elektron pada orbital normal dan orbital yang mengalami dipol sesaat. Adanya dipol sesaat menyebabkan molekul yang bersifat non-polar menjadi bersifat agak polar.